主动脉壁间血肿(intramural hematomas IMH)是一种潜在的致命性疾病。1920年,Krukenberg首先将主动脉壁内血肿(IMH)描述为“无内膜撕裂的主动脉夹层” [1],因此又常称之为不典型主动脉夹层。根据国际注册急性主动脉夹层(IRAD)[2],主动脉壁内血肿是指主动脉壁内血肿形成,并且在影像学上没有明确的夹层内膜片,没有明显的内膜撕裂。
人们把主动脉夹层Stanford分型同样运用于IMH分型,将IMH分为A型与B型[3]。IMH临床症候群与急性主动脉夹层(aortic dissections AD)极为相似,主动脉穿透性溃疡(Penetrating atherosclerotic ulcers PAU)亦有相似的临床表现,因此三者又称之为急性主动脉综合症。IMH占急性主动脉综合症患者的5-20%[4,5],其大多表现为以突发仅心前区或胸背部撕裂样疼痛为主要特征的临床症候群,部分患者无临床症状(通常由于其它疾病而做影像检查时发现),也有报道IMH的胸背痛会更严重一些[2],仅凭临床表现很难与急性主动脉夹层和主动脉溃疡相鉴别。最近十几年,影像诊断技术的飞速发展使人们对IMH有了更深的认识,通过CT、MRI和TEE等影像技术对IMH进行更为准确的诊断。
主动脉壁间血肿(intramural hematomas IMH)是一种潜在的致命性疾病。1920年,Krukenberg首先将主动脉壁内血肿(IMH)描述为“无内膜撕裂的主动脉夹层” [1],因此又常称之为不典型主动脉夹层。根据国际注册急性主动脉夹层(IRAD)[2],主动脉壁内血肿是指主动脉壁内血肿形成,并且在影像学上没有明确的夹层内膜片,没有明显的内膜撕裂。
人们把主动脉夹层Stanford分型同样运用于IMH分型,将IMH分为A型与B型[3]。IMH临床症候群与急性主动脉夹层(aortic dissections AD)极为相似,主动脉穿透性溃疡(Penetrating atherosclerotic ulcers PAU)亦有相似的临床表现,因此三者又称之为急性主动脉综合症。IMH占急性主动脉综合症患者的5-20%[4,5],其大多表现为以突发仅心前区或胸背部撕裂样疼痛为主要特征的临床症候群,部分患者无临床症状(通常由于其它疾病而做影像检查时发现),也有报道IMH的胸背痛会更严重一些[2],仅凭临床表现很难与急性主动脉夹层和主动脉溃疡相鉴别。最近十几年,影像诊断技术的飞速发展使人们对IMH有了更深的认识,通过CT、MRI和TEE等影像技术对IMH进行更为准确的诊断。
一、IMH的病理生理
目前IMH的病因并不十分清楚,可能与高血压、主动脉粥样硬化、主动脉溃疡、Marfan综合症、Turner综合症、结缔组织病、先天性主动脉瓣膜病、主动脉缩窄、主动脉瘤、怀孕妊娠以及可卡因滥用等有关[6]。
虽然IMH临床表现与急性主动脉夹层极为相似,但是其病理完全不同于主动脉夹层[7]。尽管人们对它们的病理生理已经有了进一步认识,但是到目前为止仍不清楚。IMH倾向于主动脉中膜病变,主动脉穿透性溃疡(PAU)倾向于内膜病变,而急性主动脉夹层(AD)倾向与内膜和中膜的双重病变[8]。有两种不同的病理生理进程可以导致壁内血肿的形成:㈠没有内膜破裂的IMH,认为是由于主动脉滋养血管自然性破裂在主动脉壁内形成血肿[9];㈡伴有动脉粥样硬化性溃疡的IMH,认为是由于溃疡穿透内弹性膜于主动脉壁内形成血肿[5,9,10]。许多研究者认为PAU是引起IMH的因素之一,而其他一些学者则认为PAU与IMH是完全不同的,没有任何关系的[11]。目前引用最多的解释是IMH由于主动脉壁内的滋养血管破裂所致,尽管支持这一观点的数据资料很少[8]。
IMH除累及主动脉外,还可以出现分支血管受累,并出现相应的症状,如:心肌缺血,心衰,昏迷,意识改变,肠系膜局部缺血或梗死,急性肾功能衰竭,下肢局部缺血等[2]。
IMH的临床过程不尽相同,一般有以下几种:主动脉壁内的血肿自然吸收;主动脉夹层形成;形成动脉瘤;主动脉壁破裂[12]。25-100%的接受药物治疗的患者IMH可出现部分或完全的消退[13];尽管患者积极的接受药物治疗,但IMH仍可能进展为典型AD,占病例的33%[14],其它的报道,IMH进展形成典型AD或动脉瘤,占病例的40%[13];Ide K报告32例IMH患者,11例在24个月后IMH显示吸收,18例IMH受累部分进展为动脉瘤[15];主动脉壁破裂引起的死亡占IMH死亡率的30%[14]。另一组168例IMH患者,其中25%A型IMH及13%的B型IMH进展为主动脉夹层(AD);28%A型IMH及13%的B型IMH发生主动脉破裂;28%A型IMH及76%的B型IMH病情稳定[12]。除了主动脉破裂引起死亡,内脏缺血也可以引起死亡[2]。在最近完成的国际注册急性主动脉夹层(IRAD)的研究中,IMH累及升主动脉(A型)的急性死亡率比IMH累及主动脉弓和降主动脉(B型)的4倍还要多(42%-8%)[2]。当IMH患者的年龄更年轻[16],主动脉直径小于4.0cm-4.5cm[2,16],壁间血肿的厚度小于1.0cm[2],积极的控制血压,主动脉壁间血肿更倾向于自然吸收。
由IMH进展形成的主动脉夹层不同于典型的主动脉夹层,其由主动脉中膜近外膜处分离形成真假双腔,其假腔壁较典型主动脉夹层假腔的薄[17,18]。主动脉夹层也可以转归为IMH,曾有报道主动脉夹层患者的主动脉假腔消失,IMH形成[19]。
二、IMH的影像诊断
IMH的诊断,单纯通过临床表现和实验室检查是很难与其它疾病相鉴别的,尤其是与主动脉夹层、主动脉溃疡相鉴别时就更加的困难。而运用现在的影像学技术(CT,MRI,食道内超声等)很容易对IMH做出正确的诊断,IMH在影像上主要表现为主动脉壁呈新月或环形增厚,并且没有夹层内膜片和内膜撕裂。然而IMH当与主动脉夹层假腔内急性血栓形成相鉴别时,观察者需要更加充分IMH的影像证据来证明不存在假腔内的血块与真腔之间的直接交通[6]。
IMH在影像上主要表现为主动脉壁呈新月或环形增厚,并且没有夹层内膜片和内膜撕裂。以往的研究者认为主动脉壁的厚度≥7mm是IMH的一个诊断标准[9]。而在任何一种显像模式,主动脉壁的厚度通常小于3mm,当具有预示急性主动脉综合征的临床症候群的患者的主动脉壁的厚度≥5mm时,我们相信足以诊断为IMH[20]。
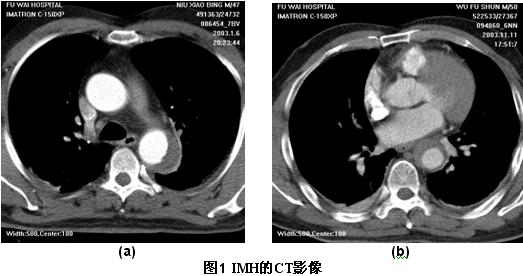
1.CT表现通常是主动脉壁呈新月或环形增厚,而主动脉真腔可发生变形或略变细,如图1所示,也可以正常。增强CT对IMH的显示通常优于平扫CT[21]。
2. MRI对IMH的诊断具有优良价值,其典型表现是主动脉壁呈新月或环形增厚,如图2所示。
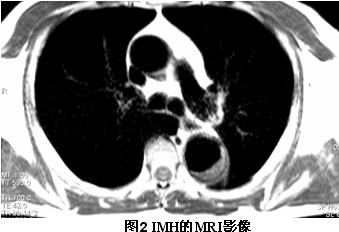
图2 IMH的MRI影像
3.IMH食道内超声(TEE)的典型征象仍是主动脉壁呈新月或环形增厚。
三、IMH的治疗
IMH如同典型主动脉夹层一样,是极为凶险的疾病,30天死亡率为20%,5年存活率为43%[12]。能够及时并且选择合适的治疗方案,对于挽救患者的生命是十分必要的。由于主动脉壁间血肿A型与B型自身的特点,需要采取不同的治疗方案。
A型IMH累及升主动脉,平均占所有IMH的40%(20-60%)[14],病情较为凶险,可进展形成典型主动脉夹层、动脉瘤或主动脉壁破裂[12],可合并其它并发症如心包积液(血)、主动脉瓣关闭不全和胸腔积液等,其中心包积液是A型IMH的一个主要临床症状,在75-100%的A型IMH的患者中均有发生[13]。对于病情发展迅速的和随访过程中发现形成主动脉夹层的IMH患者需要及时进行手术治疗[13];而对于主动脉直径大于50mm[22]或壁间血肿厚度大于12mm[23]的IMH患者建议早期手术治疗。尽管手术治疗有着不确定的风险(手术治疗后的30天死亡率为10–50%[7]),但对于A型IMH的患者只是进行观察或仅仅药物治疗,这样的风险要远大于手术的风险。有文献报道,A型IMH手术治疗后的30天死亡率为18%,而仅仅药物治疗的30天死亡率为60%[12]然而也有其他研究者建议对A型IMH进行保守治疗,并报道有良好的结果(没有出现典型AD、主动脉破裂、心包填塞和冠状动脉开口的压迫)[7]。亦有报道,A型IMH经常见到自然吸收的现象,并且有着良好的长期预后[24]。
对于IMH累及降主动脉(B型)的治疗,根据是否伴有主动脉溃疡(PAU)可以分为两种情况。不伴有主动脉溃疡的B型IMH,病情相对稳定,只需要积极进行控制血压的治疗和定期的影像学检查与随访 [25]。
伴有主动脉溃疡(PAU)的B型IMH,病情不稳定,易进一步发展。尽管有报道称伴有PAU的IMH患者中85%的患者的壁内血肿吸收消失[26]。但如患者出现不能控制的疼痛(持续的或再发的);胸腔积液增多(尽管在进展的IMH或稳定的IMH患者通常可以看到胸腔积液); IMH伴随的PAU的最大直径≥20mm或最大深度≥10mm[25];PAU位于降主动脉近端;IMH累及范围变大;主动脉直径进行性增大;壁间血肿厚度的增加等都应该更积极进行治疗,应当进行血管腔内覆膜支架置入治疗。
四、小结
IMH是一种潜在的致死性疾病,运用先进的诊疗设备对IMH做出准确而快速的诊断,并且及时采取合适的治疗方案,是使患者脱离生命危险和获得良好预后的关键。
参考文献
【1】 Krukenberg E. Beitrage zur Frage des Aneurysma dissecans. Beitr Patho Anat Allg Pathol 1920;67:329—51.
【2】 Evangelista A, Mukherjee D, Mehta RH, O’Gara PT, Fattori R, Cooper JV,
Smith DE, Oh JK, Hutchison S, Isselbacher EM, Nienaber CA, Pape LA,
Eagle KA. International; Registry of Aortic Dissection (IRAD) Investigators.
Acute intramural hematoma of the aorta: a mystery in evolution. Circulation
2005;111:1063—70.
【3】 Nienaber CA, von Kodolitsch Y, Petersen B, et al. Intramural hemorrhage
of the thoracic aorta: diagnostic and therapeutic implications. Circulation.
1995;92:1465–1472
【4】 Maraj R, Rerkpattanapipat P, Jacobs LE, Makornwattana P, Kotler MN.
Meta-analysis of 143 reported cases of aortic intramural hematoma. Am J
Cardiol 2000;86:664—8.
【5】 Harris KM, Braverman AC, Gutierrez FR, et al. Transesophageal echocardiographic and clinical features of aortic intramural hematoma.
J Thorac Cardiovasc Surg. 1997;114:619–626.
【6】 Gore I .Pathogenesis of dissecting aneurysm of the aorta.Arch Pathol
 京公网安备 11010502033353号 增值电信业务经营许可证:京ICP证150541号
京公网安备 11010502033353号 增值电信业务经营许可证:京ICP证150541号